מה זה allotropy? אלטרופיה של פחמן, כימיה
גורם מגוון של תרכובות אורגניות -את היכולת של אטומי פחמן ליצור שרשראות שונות ומחזורים, מתחברים אחד עם השני. כלומר, תופעת האיזומריזם. ומה הסיבה למגוון של חומרים אנאורגניים פשוטים? מתברר כי שאלה זו ניתן לענות על ידי בהתחשב מה allotropy הוא. זה עם תופעה טבעית זו בעולם של יסודות כימיים כי קיומו של צורות שונות של תרכובות פשוטות קשורה.
מה זה allotropy?
אתה יכול לענות על שאלה זו בדרך זו. תופעה זו היא קיומו של אותו יסוד כימי בצורה של מספר חומרים פשוטים. כלומר, אם התאים בטבלה המחזורית 118, אז זה לא אומר שיש אטומים רבים כמו בטבע של אטומים גם כן. לכל אחד מהרכיבים (כמעט כולם) יש זן אחד או יותר, או שינויים allotropic.
מה ההבדל בין חומרים כאלה? הסיבות לתופעה זו הן השתיים העיקריות:
- מספר שונה של אטומים במולקולה (allotropy של הרכב);
- מבנה שוויונית של סריג קריסטל (טופס allotropy).
לעתים קרובות מושג זה קשור למונחפולימורפיזם. עם זאת, יש הבדל ביניהם. מה זה allotropy? זהו שינוי של האלמנט הכימי בחומרים פשוטים שונים, ללא תלות במצבה המצטבר. בעוד פולימורפיזם הוא מושג החלים רק על חומרים גבישיים מוצקים.
שינויים allotropic שונים של תרכובותנהוג להשתמש באותיות לטיניות לפני שמם. אלפא תמיד ממוקם לפני הטופס שיש לו את נקודת ההתכה המינימלית, נקודת רתיחה. בהמשך על פי סדר אלפביתי עלייה אינדיקטורים בהתאם.
למרות העובדה כי יסוד כימי בבסיסחומרים פשוטים זהים, המאפיינים של השינויים שונים זה מזה באופן משמעותי, הן פיזית והן כימית. הצורות הכי אלוטרופיות שנוצרו בקלות:
- לא מתכות (למעט גזים הלוגניים ואינרטיים);
- סמלים.
Alotropy של מתכות כבר למד לפחות, מאזהם עושים שינויים כאלה באי רצון ולא כולם. בסך הכל, יותר מ 400 צורות שונות של חומרים פשוטים ידועים עד כה. ככל שיותר מעלות החמצון אופייניות לאלמנט, כך גדל מספר השינויים האלטרופיים הידועים לו.

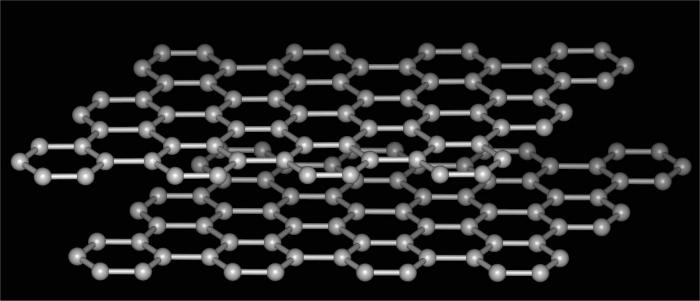
שינויים בפחמן
פחמן allotropy הוא הנפוץ ביותרודוגמה חיה הממחישה את התופעה הנדונה. אחרי הכל, אלמנט זה הוא מסוגל ליצור מספר סוגים של תרכובות, שונה במבנה של קריסטל הסריג. חומרים פשוטים וכתוצאה מכך הם כל כך קוטבי המאפיינים שלהם זה נשאר להיות מופתע פתרונות של הטבע.
לכן, allotropy של פחמן כוללת את השינויים הבאים.
- מה הוא allotropy של פחמן ניתן לייחס ועל הצורה הבאה שלה, אשר שונה באופן קיצוני מן הקודם. זהו גרפיט. חומר רך מאוד שיכול בקלות לקלף ולהשאיר סימן אופייני על הנייר. לכן, הוא משמש לייצור פתילים של עפרונות פשוטים. המבנה של צורה זו הוא משושה שכבות. הקשרים בין interlayers חלשים, קרועים בקלות, צפיפות החומר הוא נמוך. משמש גרפיט לייצור יהלומים סינתטיים, כמו חומר סיכה מוצק, לייצור של אלקטרודות, כמו מילוי של פלסטיק, כמו גם כורים גרעיניים.
- פולרנים הם הוכחה נוספת לכךיש allotropy. הכימיה של תרכובות אלה דומה לזו של פחמימנים ארומטיים. אחרי הכל, המבנה שלהם מיוצג על ידי polyhedra סגור קמור הדומה כדורגל. Fullerenes משמשים בהנדסה כמוליכים למחצה, לייצור תרכובות מוליכות, כמו photoresist וכן הלאה.
- Lonsdaleite ו ceraffite - שני גבישי יותרשינויים allotropic של פחמן. הם התגלו יחסית לאחרונה. על ידי מאפיינים דומים מאוד יהלום, בהעדר זיהומים יכול להיות אפילו כמה פעמים יותר קשה.
- פחם ופיח הם חומרים אלוטרופיים אמורפיים. משמש דלק, חומרי סיכה, במסננים וכן הלאה. לפי התוכן בטבע, הנפוץ ביותר של כל השינויים של פחמן.

יהלום
הכי קשה של כל הידוע היוםחומרים, מוערך ב 10 נקודות על סולם מוס. הצורה הגבישית של פחמן, אשר מבנהו יש צורה של חיבורים tetrahedral מחובר אחד לשני.
יהלום הוא מסוגל לפזר אור טוב מאוד, כימאפשר לך להשתמש בו כתכשיטים (יהלומים). בשל קשיחות קיצונית שלה, הוא משמש לחיתוך ריתוך, קידוח, ליטוש שחיקה. עד כה הוקם ייצור של יהלומים מלאכותיים המשמשים בתעשייה.
זנים אחרים
ישנם גם כמה סוגים של אלמנט זה:
- צינורות;
- nanopeny;
- אסטרולוגים;
- ננופיבר;
- פחמן מזכוכית;
- גרפנים;
- קרביין;
- ננו לחמניות.
צורות לא ידועות של צורות פחמן פשוטות: chaot, פחמן מתכתי ופחמן דו-חמצני.
אלטרופיה של חמצן
זה לא מתכת צורות שני חומרים פשוטים:
- גז חמצן (בתנאים רגילים), נוסחה אשר O2;
- אוזון גזי, ההשתקפות האמפירית של הרכב O3.
ברור, הנה הסיבה העיקריתקיומם של שינויים - הרכב המולקולה. חמצן רגיל הוא הבסיס של החיים של כל היצורים החיים (למעט חיידקים אנאירוביים). הוא משתתף פעיל בחילופי גז, מקור אנרגיה לכל תהליכי החיים. מבחינה כימית, הוא מחמצן, שדרכו מתבצעות תגובות רבות.
אוזון נוצר בטבע או מיוחדמתקני מעבדה של אוזוניזרים מחמצן האוויר בהשפעת פריקה חזקה של חשמל. בתנאים טבעיים, זה ברק. בריכוזים נמוכים מפוזרים יש לה ריח נעים של רעננות (אחרי סופת רעמים היא תמיד חשה באוויר). זהו מחמצן חזק מאוד, אקונומיקה, פעיל כימית.

שינויים בזרחן
Allotropy של חמצן דומה לזו של זרחן. יש לה גם 11 שינויים שונים, שונים במספר האטומים במולקולה, ולכן הקשר הכימי והמאפיינים. ישנן שלוש צורות יציבות והשאר, בטבע, כמעט לא מתרחש ומתפורר.
- זרחן לבן. הנוסחה של P שלה4. חומר הדומה פרפין רך של צבע לבן או צהבהב מעט. נמס בקלות, עובר לתוך גז רעיל.
- זרחן אדום הוא מסה דמויית עיסה עם ריח לא נעים. פורמולה - Pn. זהו מבנה פולימרי.
- זרחן שחור הוא שמנוני למגע המגע, שהוא שחור לחלוטין מסיס במים.
שינויים במתכות
מהו allotropy של מתכות, אתה יכול ללמוד מהדוגמה של ברזל. הוא קיים בצורה:
- אלפא;
- ביתא;
- גמא;
- טופס סיגמא.
כל אחד מהם שונה מהמבנה הקודם של הסריג הגבישי, ובהתאם לנכסים. לדוגמה, צורת אלפא היא פרומגנטית, ואת ביתא פרמגנט.
באופן כללי, מכל מתכות ידוע allotropic שינויים טופס רק 27 יסודות כימיים.

פחית פח
מעניין, צורת אלפא הוא אפוראבקה שקיימת רק בטמפרטורות נמוכות. בטא, לעומת זאת, הוא מתכת, לבן כסוף, רך ופלסטיק. זה קיים בטמפרטורות גבוהות - עד 161 oג. טופס אחד עובר בקלות לתוך השני בתנאים טבעיים, אם יש הבדל צבע.





